В периодической системе в одной группе с аргоном находится химический элемент:
Централизованное тестирование по химии, 2017
В атоме химического элемента 24 электрона. Его относительная атомная масса равна:
Атом ![]() и анион водорода
и анион водорода ![]() в основном состоянии подобны между собой:
в основном состоянии подобны между собой:
Согласно положению в периодической системе наибольшее значение электроотрицательности имеет химический элемент с порядковым номером:
Ковалентная связь имеется во всех веществах ряда:
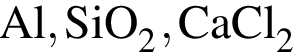
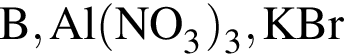
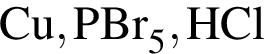
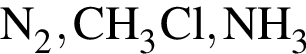
Установите соответствие между формулой вещества и степенью окисления в нем атома химического элемента,указанного в скoбках.
1) OF2(O)
2) NH4Cl(N)
3) KHCO3(C)
a) –3
б) –2
в) +2
г) +3
д) +4
Количество (моль) катионов, содержащихся в 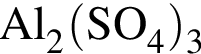 массой 239,4г, равно:
массой 239,4г, равно:
С помощью прибора, изображенного на рисунке, способом вытеснения воздуха (Mr=29) с наименьшими потерями можно собрать газ:
Укажите формулу основного оксида:
Число веществ среди предложенных - 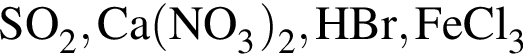 , с которыми реагирует разбавленный водный раствор
, с которыми реагирует разбавленный водный раствор ![]() :
:
Двухосновная бескислородная кислота образуется при взаимодействии в водном растворе веществ:
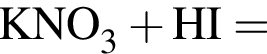
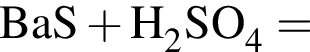
Укажите утверждение, верно характеризующее соль 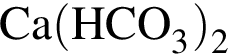 :
:
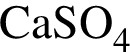
Установите соответствие между веществом и его кристаллической решеткой при н. у.:
1) йод
2) моноклинная сера
3) бор
4) карбид кремния
решетка
а) атомная
б) молекулярная
![]() в отличие от
в отличие от ![]() :
:
а — можно получить из простых веществ
б — относится к сильным кислотам
в — реагирует с раствором нитрата серебра(I)
г — НЕ окисляется хлором
Выберите утверждения, верно характеризующие озон:
a) в присутствии катализатора превращается в кислород;
б) является сильным окислителем;
в) имеет относительную плотность по азоту более 2;
г) обладает резким запахом;
Выберите утверждение, верно характеризующее фосфор:
a) в природе встречается в составе фосфоритов;
б) белый фосфор состоит из молекул ![]() ;
;
в) недостатком кислорода окисляется до степени окисления +3;
г) в реакции с калием образует фосфат калия;
Избыток газа, полученного действием серной кислоты на известняк, пропускают в стакан с известковой водой. При этом в стакане:
Железный гвоздь погрузил в разбавленный водный раствор вещества Х. При этом масса гвоздя НЕ изменилась. Веществом Х является:
Укажите верное утверждение относительно 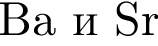 :
:
К раствору серной кислоты добавили алюминий массой 9г. В результате реакции массовая доля кислоты в растворе снизилась от 28% до 7%. Масса(г) исходного раствора:
Образование ![]() из простых веществ протекает по термохимическому уравнению
из простых веществ протекает по термохимическому уравнению 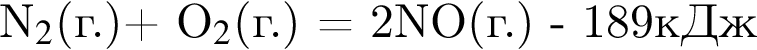 . При разрыве связей в молекулах
. При разрыве связей в молекулах ![]() количеством 1моль поглощается 945кДж теплоты, а при образовании связей в молекулах
количеством 1моль поглощается 945кДж теплоты, а при образовании связей в молекулах ![]() количеством 1моль выделяется 627кДж теплоты. Укажите количество теплоты (кДж), которая поглощается при разрыве связей в молекулах
количеством 1моль выделяется 627кДж теплоты. Укажите количество теплоты (кДж), которая поглощается при разрыве связей в молекулах ![]() количеством 1моль:
количеством 1моль:
Сумма коэффициентов перед веществами молекулярного строения в уравнении реакции, протекающей по схеме 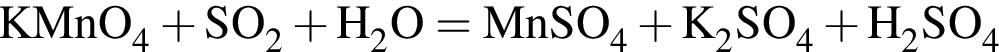 , равна:
, равна:
В водном растворе аммиака установилось следующее равновесие:  . Количество молекул
. Количество молекул ![]() в растворе увеличится, если добавить в раствор:
в растворе увеличится, если добавить в раствор:
а) порцию воды;
б) немного твердого гидроксида натрия;
в) немного твердого сульфата аммония;
г) немного углекислого газа.
При охлаждении насыщенного водного раствора ![]() до
до ![]() С в стакане выпал осадок. Укажите правильное утверждение:
С в стакане выпал осадок. Укажите правильное утверждение:
Лампочка прибора для определения электропроводности (см.рис) НЕ изменит яркость,если в разбавленный раствор
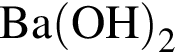 добавить:
добавить:
При добавлении к воде оксида фосфора (V):
а) рН увеличивается;
б) концентрация ионов ![]() НЕ изменяется;
НЕ изменяется;
в) концентрация ионов ![]() увеличивается;
увеличивается;
г) рН уменьшается.
Модель молекулы этанола изображена на рисунке:
Для превращения 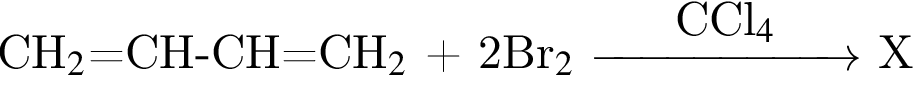 верно:
верно:
Гомологи образуются при гидрировании избытком водорода углеводородов пары:
Дана схема превращений 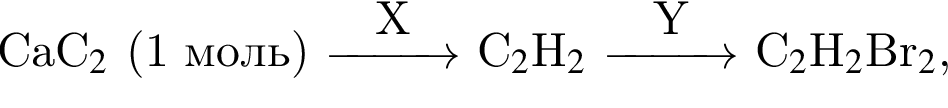 где Х и Y соответственно:
где Х и Y соответственно:
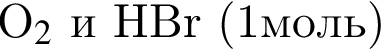
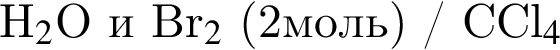
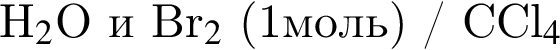
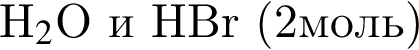
В результате реакции 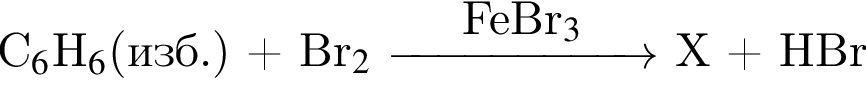
получен бромоводород количеством 0,6 моль. Масса (г) органического продукта Х составляет:
Как глицерин, так и глюкоза:
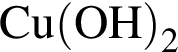
К водному раствору, содержащему фенол массой 29,14г, добавили водный раствор, содержащий гидроксид калия массой 14,0г. После завершения реакции масса (г) фенола в полученном растворе составляет:
Строение карбоксильной группы верно отражено на рисунке:
В качестве моющего средства можно использовать вещество, формула которого:
Укажите верное утверждение относительно сахарозы:
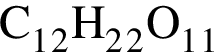
Число пептидных связей в молекуле равно:
Мономером для получения полимера является вещество:
Альдегид А имеет молярную массу меньше 45 г/моль. При гидрировании А образуется вещество Б с молярной массой больше 45 г/моль. Нагревание Б с концентрированной серной кислотой приводит к образованию газа (н. у.) В и неорганического вещества Г. При окислении Б перманганатом калия в кислой среде может быть получено органическое вещество Д, водный раствор которого окрашивает лакмус в красный цвет. Найдите сумму молярных масс (г/моль) веществ В и Д.
Выберите утверждения, верно характеризующие олеиновую кислоту.
| 1 | В молекуле содержится НЕчетное число атомов углерода |
| 2 | |
| 3 | При гидрировании образует кислоту С17Н35СООН |
| 4 | В реакции с бромом образует вещество, формула которого СН3 – (СН2)7 – СНВr – (CH2)8 – СООН |
| 5 | Остатки кислоты содержатся в животных жирах |
| 6 | При взаимодействии с водным раствором гидроксида калия образуется соль С17Н33СООК и выделяется Н2. |
Ответ запишите в виде последовательности цифр в порядке возрастания, например: 245 .
Газообразная смесь алкана с этеном имеет объем (н. у.) 6,72дм3. Половину смеси пропустили через сосуд с избытком бромной воды. При этом масса сосуда с содержимым выросла на 0,7г. Вторую половину смеси сожгли в избытке кислорода, в результате чего образовалась вода массой 5,4 г. Определите молярную массу (г/моль) смеси углеводородов.
Определите сумму молярных масс (г/моль) азотсодержащих веществ А и Б, полученных в результате следующих превращений:
Дан перечень неорганических веществ: аммиачная селитра, графит, гидроксид магния, гидросульфит калия, кремнезем, оксид фосфора(V), фтор, хлорид меди(II). Укажите число высших оксидов, нерастворимых оснований, солей и простых веществ соответственно.
Ответ запишите цифрами, соблюдая полученную последовательность, например: 1322.
Простое газообразное вещество А желто-зеленого цвета с резким запахом реагирует с металлом Б, в результате чего получается вещество В. Газ А имеет плотность (н. у.), равную 3,17г/дм3. Химический элемент, образующий Б, в соединениях имеет валентность II, а избыток его катионов обуславливает жесткость воды. При действии на В массой 25,02г избытка концентрированной серной кислоты с выходом 89% выделяется бесцветный, хорошо растворимый в воде газ Г объемом (н. у.) 10,5дм3. Определите сумму молярных масс (г/моль) веществ А и В.
Для получения веществ по схеме превращений:
![]() →
→![]() →
→ 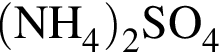 →
→ ![]() →
→ ![]()
выберите варианты из предложенных:
1 - 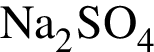
2 - ![]()
3 - ![]()
4 - 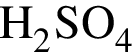
5 - ![]()
6 - ![]()
Ответ запишите цифрами в порядке следования превращений, например, 5314.
В четырех пронумерованных пробирках находятся разбавленные растворы неорганических веществ. О них известно следующее:
- растворы из пробирок 2 и 3 нейтрализуют друг друга;
- при добавлении хлора в пробирку 1 образуется красно-коричневая жидкость (н. у.);
- при смешивании содержимого пробирок 2 и 4 выпадает осадок, который растворяется как в кислотах, так и в щелочах.
Установите соответствие между названием вещества и номером пробирки, в котором находится раствор данного вещества.
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например, А1Б4В3Г2.
Уксусная кислота широко применяется в качестве консерванта (пищевая добавка Е260). В быту чаще всего используют уксус (массовая доля кислоты 9%, 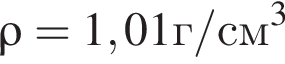 ) или уксусную эссенцию (массовая доля кислоты 70%,
) или уксусную эссенцию (массовая доля кислоты 70%,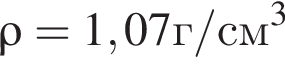 ). Для консервирования овощей требуется 225см3 уксуса. Вычислите, в каком объеме воды (см3) необходимо растворить уксусную эссенцию, чтобы приготовить раствор для консервирования.
). Для консервирования овощей требуется 225см3 уксуса. Вычислите, в каком объеме воды (см3) необходимо растворить уксусную эссенцию, чтобы приготовить раствор для консервирования.
Найдите сумму молярных масс (г/моль) алюминийсодержащих веществ Б и Д,образовавшихся в результате следующих превращений:

В результате поджигания смеси объемом (н. у.) 800дм3, состоящей из сероводорода, взятого в избытке, и кислорода, образовались сера и вода. После приведения полученной смеси к нормальным условиям в газообразном состоянии остался только сероводород объемом 200дм3. Рассчитайте объемную долю (%) кислорода в исходной смеси.
Для анализов смеси хлоридов натрия и аммония провели следующие операции. Навеску смеси массой 5г растворили в воде. К полученному раствору прибавили 300г раствора гидроксида калия с массовой долей ![]() 2,8% и нагрели до полного удаления аммиака. В образовавшийся раствор добавили метиловый оранжевый, а затем акуратно прибавляли соляную кислоту, пока среда раствора не стала нейтральной. Объем израсходованной кислоты равен 150см3, концентрация HCl в кислоте 0,5моль/дм3. Вычислите массовую долю(%) хлорида аммония в исходной смеси.
2,8% и нагрели до полного удаления аммиака. В образовавшийся раствор добавили метиловый оранжевый, а затем акуратно прибавляли соляную кислоту, пока среда раствора не стала нейтральной. Объем израсходованной кислоты равен 150см3, концентрация HCl в кислоте 0,5моль/дм3. Вычислите массовую долю(%) хлорида аммония в исходной смеси.

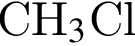 - ковалентная полярная,
- ковалентная полярная, 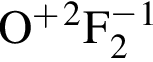

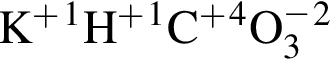
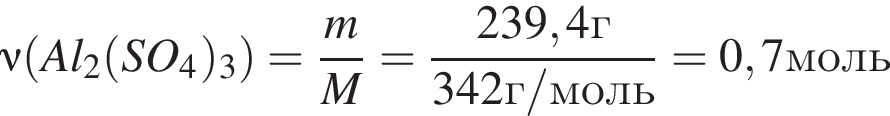
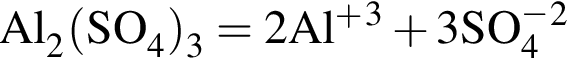
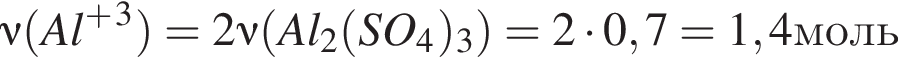


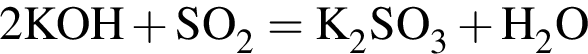
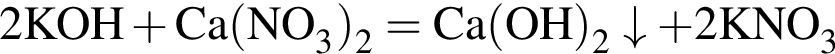
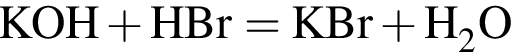
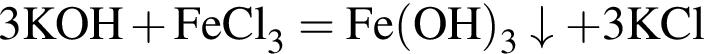
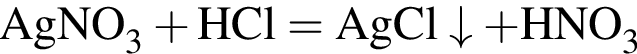
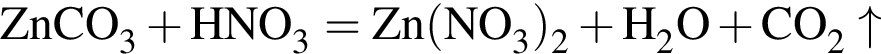
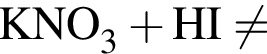
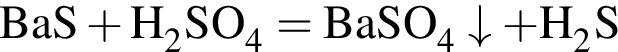
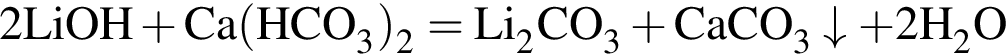
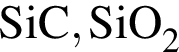 .
. .
.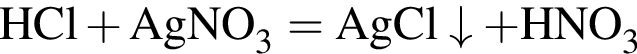
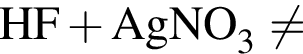
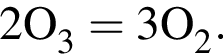
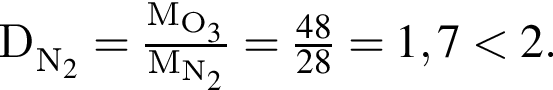
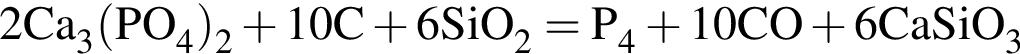
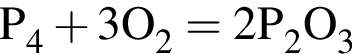
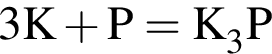
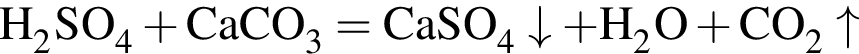
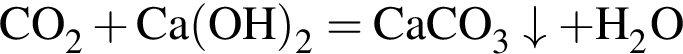
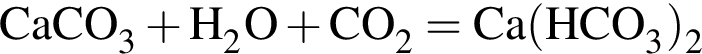
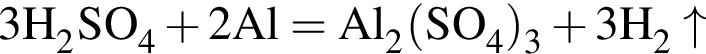
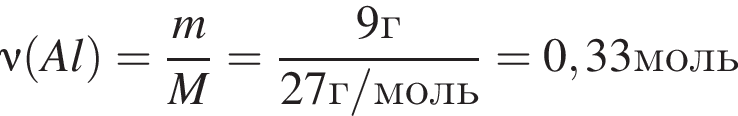
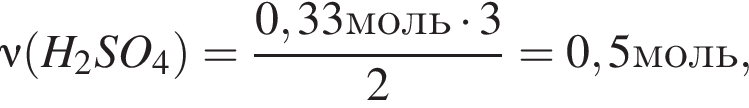 откуда
откуда  и
и 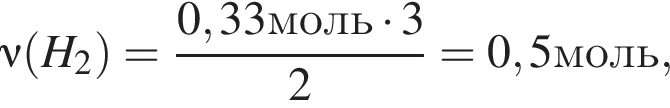 откуда
откуда 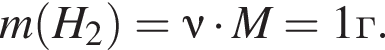
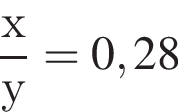
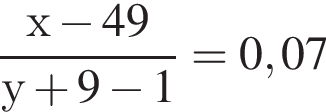
 т. е.
т. е.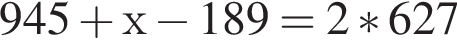
 →
→  →
→ 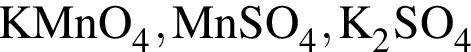 - вещества ионного строения,
- вещества ионного строения,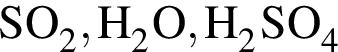 - вещества молекулярного строения.
- вещества молекулярного строения.
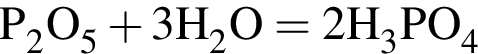
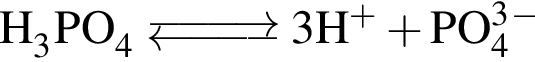
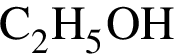 . Остальные модели соответствуют:
. Остальные модели соответствуют: 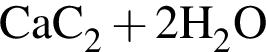 →
→ 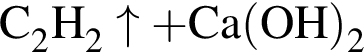
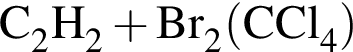 →
→ 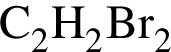
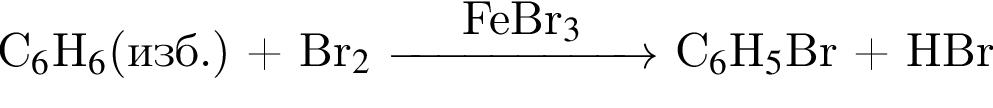
 учитывая стехиометрические коэффициенты уравнения реакции, очевидно, что:
учитывая стехиометрические коэффициенты уравнения реакции, очевидно, что:
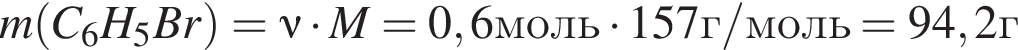
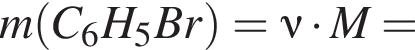
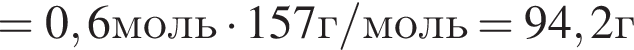
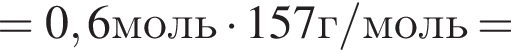
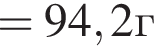
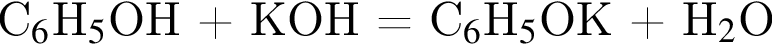
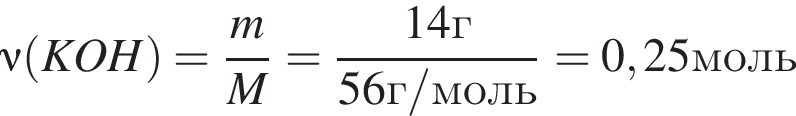
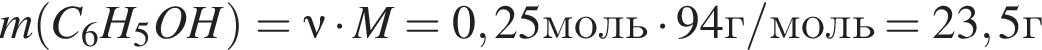

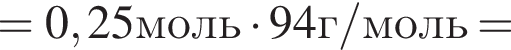
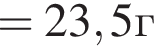
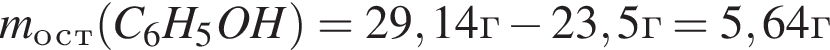

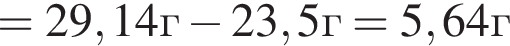
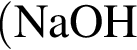 в твердых мылах,
в твердых мылах, 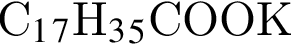 .
.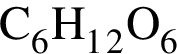 и глюкозы
и глюкозы 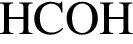 (Mr=30 г/моль) и
(Mr=30 г/моль) и 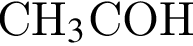 (Mr=44 г/моль). Прогидрируем их:
(Mr=44 г/моль). Прогидрируем их: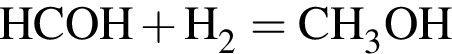
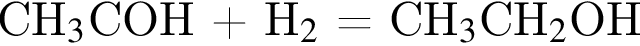
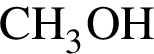 )= 32 г/моль, что меньше 45г/моль,
)= 32 г/моль, что меньше 45г/моль,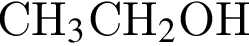 )= 46 г/моль, что больше 45г/моль. Следовательно, А -
)= 46 г/моль, что больше 45г/моль. Следовательно, А - 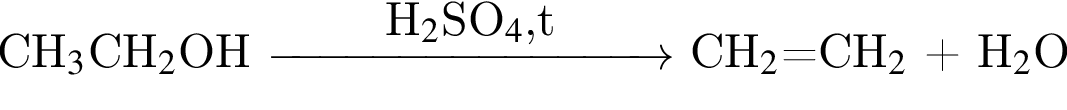 , где В -
, где В - 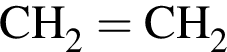 , а Г -
, а Г - 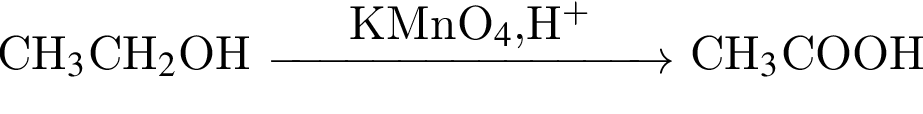 . Д -
. Д - 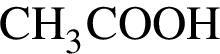 , который окрашивает лакмус в красный цвет.
, который окрашивает лакмус в красный цвет. 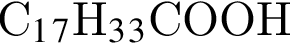 . Очевидно, что у нее четное количество атомов углерода.
. Очевидно, что у нее четное количество атомов углерода.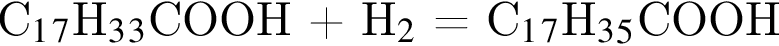
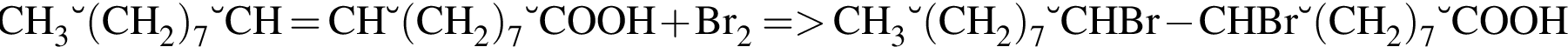
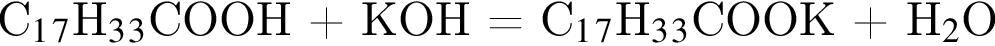
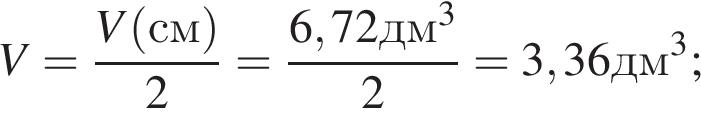
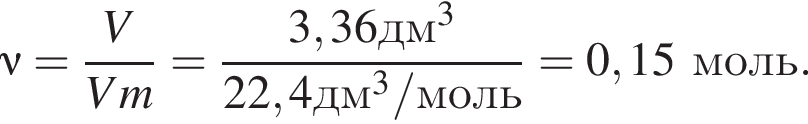
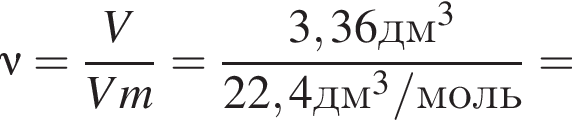
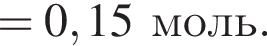
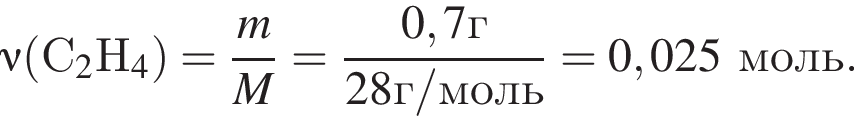
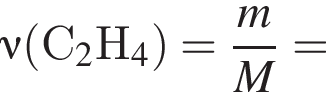
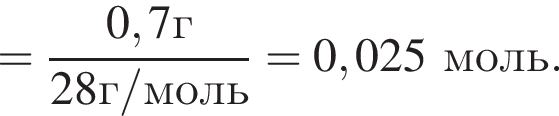
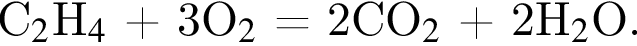
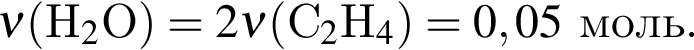
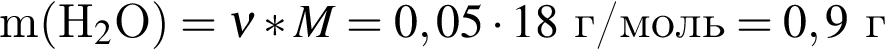
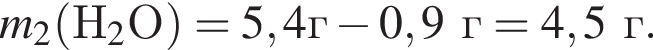
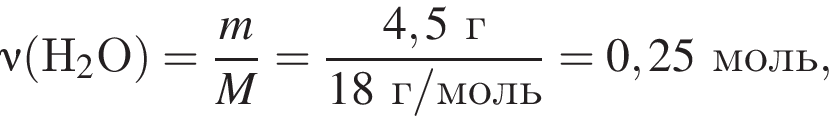
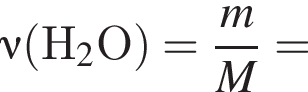
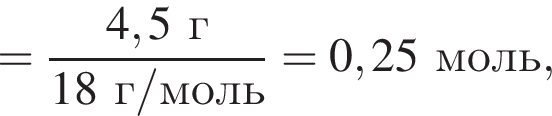

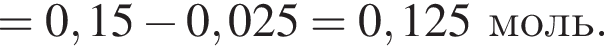
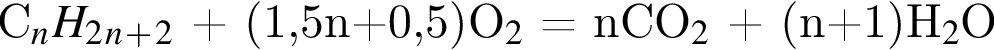
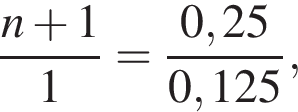 откуда n = 1, следовательно, это метан.
откуда n = 1, следовательно, это метан.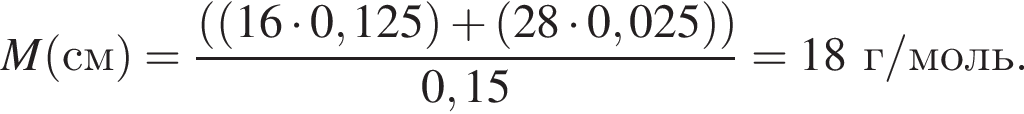
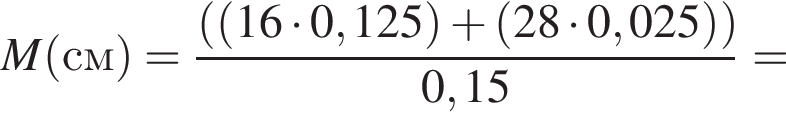
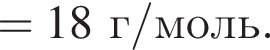

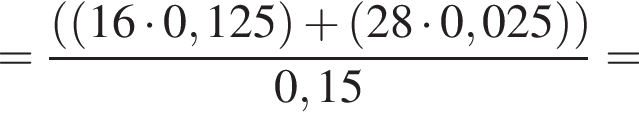
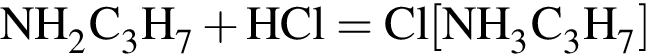
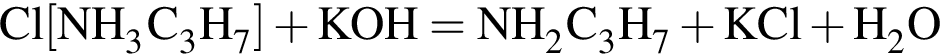
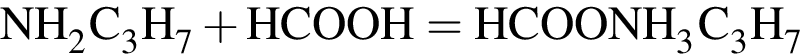
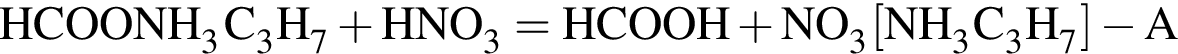
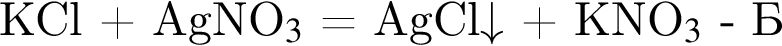
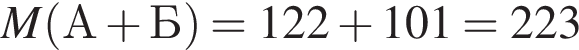
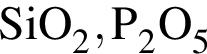 ;
;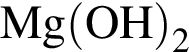 ;
;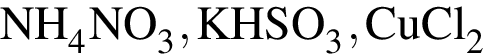 ;
;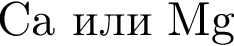 , т. к. они оба в соединениях имеют валентность II, а избыток их катионов обуславливает жесткость воды.
, т. к. они оба в соединениях имеют валентность II, а избыток их катионов обуславливает жесткость воды. 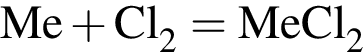 , где
, где 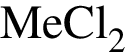 - вещество В.
- вещество В.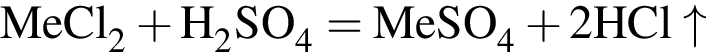 , где
, где 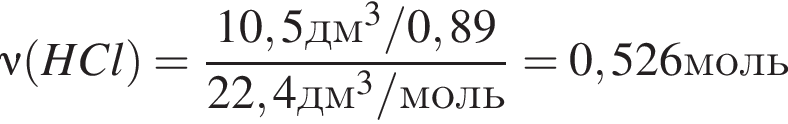
 Откуда
Откуда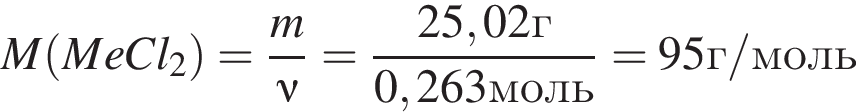

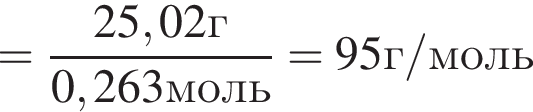

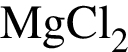 .
.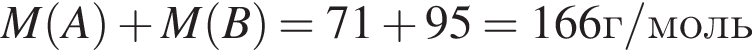
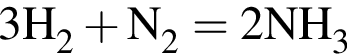
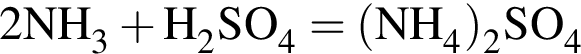
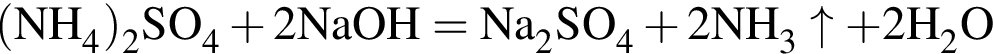
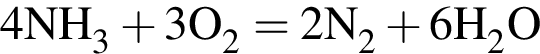
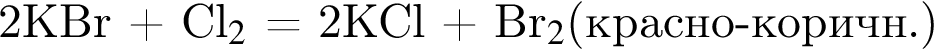 значит, в 1-й пробирке находится бромид калия.
значит, в 1-й пробирке находится бромид калия.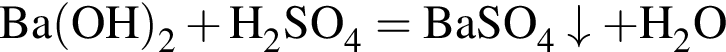 - реакция нейтрализации. Тогда в оставшейся 4-й пробирке находится нитрат цинка.
- реакция нейтрализации. Тогда в оставшейся 4-й пробирке находится нитрат цинка.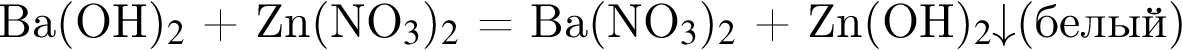
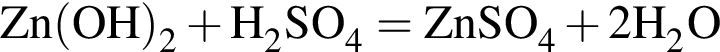
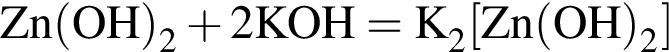
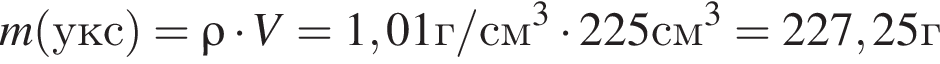


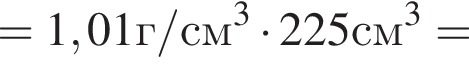

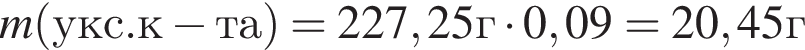
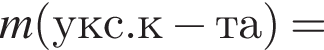
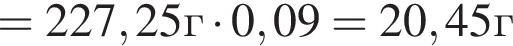
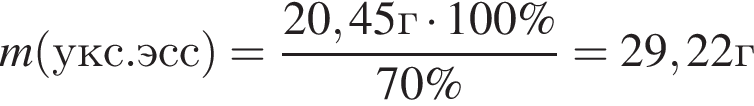
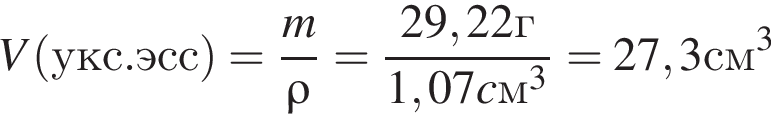
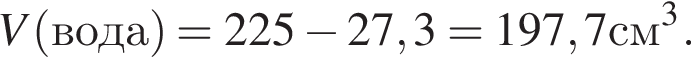 Округлив до целых, получим 198см3.
Округлив до целых, получим 198см3.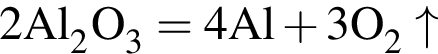
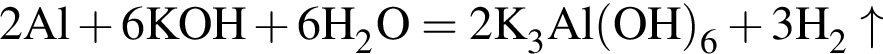
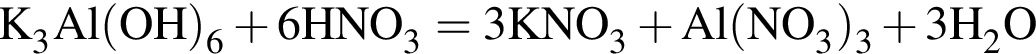
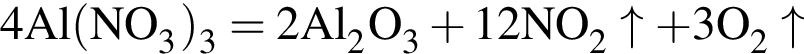
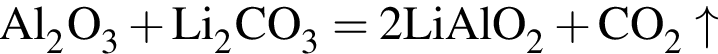
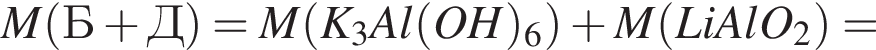


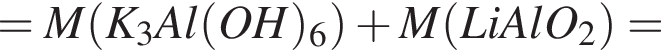
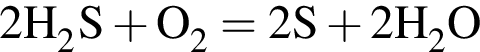
 т. е. V(
т. е. V(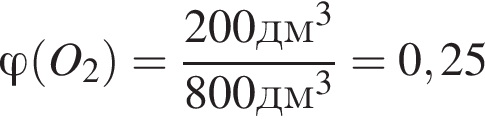 (25%).
(25%).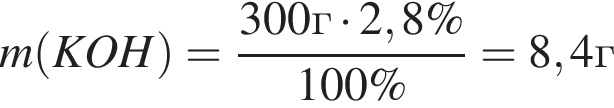
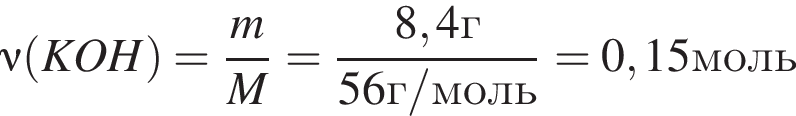
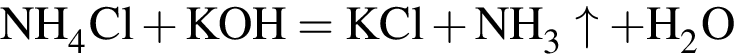 , оставшийся
, оставшийся 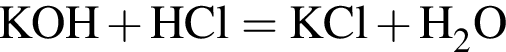
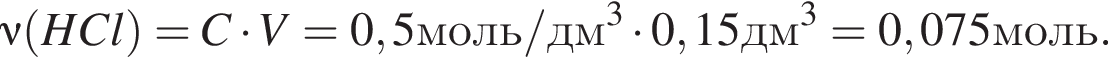

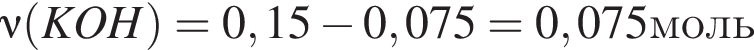 прореагировало с
прореагировало с 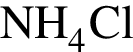 .
. Найдем массу хлорида аммония:
Найдем массу хлорида аммония:

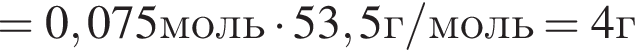
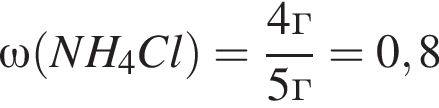 (80%)
(80%)